导读:对于不能手术的食管腺癌(EAC),确定可能从最近批准的免疫化疗(ICI+CTX)治疗中获益的患者仍然是一个关键挑战。我们通过一项特别设计的机会之窗试验(LUD2015-005)解决了这个问题,其中35名不能手术的EAC患者接受了为期四周的一线免疫检查点抑制剂(ICI- 4w),然后是ICI+CTX。
综合生物标志物分析,包括生成65000个食管癌单细胞rna测序图谱,以及ICI-4W期间EAC的多时间点转录组学分析,揭示了一种新的T细胞炎症特征(INCITE),其上调与ICI诱导的肿瘤缩小相关。使用我们的单细胞图谱对治疗前胃食管癌转录组进行反卷积,发现高肿瘤单核细胞含量(TMC)是LUD2015-005患者更高总生存率(OS)和独立队列中流行胃癌亚型ICI反应的意外ICI+ ctx特异性预测因子。肿瘤突变负担是LUD2015-005 OS的另一个独立和累加的预测因子。TMC可以改善胃食管癌患者对新出现的ICI+CTX治疗的选择。
https://www.cell.com/cancer-cell/fulltext/S1535-6108(23)00216-7#%20
研究背景
01
免疫检查点抑制剂(ICIs)免疫治疗已成为癌症治疗的第四大支柱,与化疗(CTX)、放疗和手术并列。越来越多的患者接受ICIs治疗,无论是单独治疗还是联合CTX治疗(免疫化疗[ICI+CTX])。尽管使用ICIs的患者预后有令人兴奋的改善,但只有少数患者使用这些药物获得长期益处随着监管部门批准的数量不断增加,以及数千项正在进行的免疫疗法临床试验,确定最有可能从基于免疫球蛋白的疗法中受益的患者仍然是一项关键挑战。
先前的研究确定了对ICI反应的一些关键预测因子,包括肿瘤突变负担(TMB)、T细胞炎症标记物和靶向检查点分子的表达,如PD-1或PD-L1.3。预测ICI有利结果的生物标记物可能无法预测单独使用CTX或ICI+CTX的结果,因为ICI通过刺激免疫系统起作用,而CTX与DNA损伤剂可以损害癌症和非恶性免疫细胞。因此,从CTX的混杂效应中分离ICI特异性信号是识别生物标志物的关键一步,这些生物标志物可以帮助选择ICI+CTX适应症范围不断扩大的患者。TMB仍然是研究最充分的ICI反应的基因组预测因子之一,尽管这种生物标志物在所有癌症类型中可能具有相同的效用消除TMB的作用,并找到新的生物标志物来补充其预测效用,将提高我们选择患者进行免疫化疗的能力。
食管癌是导致癌症死亡的第六大原因。食管腺癌(EAC)是西方世界的主要亚型,是过去几十年发病率增长最快的癌症类型之一。约40%的食管癌在诊断时存在远处转移。对于这些不能手术的患者,常规一线氟嘧啶和铂CTX的中位生存期小于1年。2021年,美国食品和药物管理局(FDA)批准了一线ICI+CTX方案,使用αPD-1 ICI联合铂/氟嘧啶CTX治疗无法手术的胃食管癌。然而,ICI的传统预测生物标志物在这种情况下显示出不同的预测效用。使用联合阳性评分(CPS)方法进行组织学评估的高PD-L1表达显示,在一些晚期胃食管癌的一线III期试验中,在CTX中添加ICI与增加的生存获益有关,和一些地区使用CPS阈值来确定这些癌症中αPD-1 ICI+CTX的资格然而,在其他αPD-1 ICI+CTX胃食管癌试验中,PD-L1表达与预后改善无关。在一线环境中,一项研究报告了与CTX24相比,ICI+CTX对tmb -高患者的获益程度增加;而在预治疗的胃食管癌中,TMB要么没有显示出与ICI结果的显著关联,要么在多变量回归后不保持显著性微卫星不稳定性(MSI)和eb病毒(EBV)相关的胃食管癌倾向于对含有ICI的方案反应特别好,但这些特征仅存在于一小部分胃癌(GC)中,而在EAC中很少或不存在。这些研究结果强调需要确定其他生物标志物,以确定哪些胃食管癌患者将从ICI+CTX中获益最多,特别是对于快速增长的EAC患者群体。
2015年启动的I/II期LUD2015-005试验为解决这些挑战提供了独特的机会。不能手术的食管癌患者,主要是EAC,在ICI+CTX之前,单独使用ICI治疗4周(ICI- 4w)。在治疗前、治疗期间和治疗后分别对正常和恶性胃肠道组织进行配对活检。该设计可在整个治疗过程中使用全基因组测序(WGS)、单细胞RNA测序(scRNA-seq)和大量RNA测序(bulk RNA-seq)进行全面的临床和分子分析。在CTX混杂影响之前,对ci - 4w前后收集的序贯肿瘤活检进行分析,确定了治疗反应性分子特征,这些分子特征与EAC对一线仅ci的反应和耐药性相关,并预测了其他情况下的长期ICI结局。通过反卷积整合scRNA-seq和bulk RNA-seq也揭示了肿瘤内细胞类型组成在预测基于ci的治疗的长期结果中的关键作用,无论是在LUD2015-005还是在ci治疗的GC验证队列中。为了确保LUD2015-005研究中发现的预测性生物标志物对含ci方案具有特异性,研究人员还对来自癌症基因组图谱(TCGA)和国际癌症基因组联盟(ICGC) 的EAC患者进行了预测效用测试,这些患者的药物治疗主要由传统的CTX组成。我们还研究了细胞组成生物标志物与TMB的关系,旨在建立可以补充TMB的治疗前生物标志物,以提高对胃食管癌ICI+CTX长期预后的预测。
研究结果
02
生成65,000个细胞的上GI细胞图谱并建立反褶积工作流程
为了确定哪些髓细胞类型可能影响ICI+CTX结果,我们整合了来自scRNA-seq和bulk RNA-seq的证据。我们首先生成了LUD2015-005上消化道细胞图谱,这是一个65000个细胞的scRNA-seq数据集,来自18名患者的病变和正常胃食管组织,包括不可手术和可手术的EAC、ESCC和恶性前病变Barrett食管。我们确定了46种主要的细胞类型,具有良好的上皮细胞、基质细胞、淋巴细胞和吞噬免疫细胞区室的代表性。LUD2015-005图谱数据证实了INCITE基因在T细胞和NK细胞中特异性表达,并证实了EAC中单核细胞、巨噬细胞和中性粒细胞水平升高。来自EAC样本的许多细胞类型在该数据集中表达髓细胞靶向细胞因子和趋化因子:特别是髓细胞本身,但也有一部分肿瘤细胞。最后,该图谱显示,在大量RNA-seq差异表达中,与CB相关的先天免疫deg主要由单核细胞、中性粒细胞和m1样巨噬细胞表达,这表明EAC中特征性骨髓浸润向一种或多种这些细胞类型倾斜,预示着更好的ICI+CTX结果。
为了进一步确定哪种髓细胞类型主要负责与CB的关联,我们进行了反褶积来计算试验衍生的大量RNA-seq样本的细胞组成。为了以LUD2015-005 scRNA-seq图谱为参考,选择性能最佳的反褶积算法,我们首先汇集了单细胞转录组,创建了80个已知细胞组成的伪体RNA-seq样本。我们将反褶积估计与真实伪体组成进行了比较,发现BayesPrism45在所有测试算法中具有最小的中位数误差和最高的中位数相关性。因此,我们选择BayesPrism使用LUD2015-005图集进行反卷积。在先前发表的RNA-seq数据集中,这种反卷积方法能够将EAC的上皮和微环境组成与其他食管组织类型(包括密切相关的Barrett食管)区分开来。因此,选择BayesPrism反褶积工作流程来估计LUD2015-005批量转录组的细胞组成。
TMC确定胃食管癌患者可能受益于基于ci的治疗
对所有LUD2015-005 EAC活检进行反褶积细胞组成估计。在prex中,评估吞噬免疫室,肿瘤单核细胞含量(TMC)高的EACs群的CB率(8/12[67%])高于其他EACs群(5/20 [25%])。上皮细胞、基质细胞或淋巴细胞免疫室的细胞类型与结果无显著关联。各细胞类型prex水平的Cox回归分析显示,TMC与OS的改善密切相关,在多重检验校正后仍然显著(HR: 0.38 (95% CI: 0.22-0.67), p = 0.0008, FDR [benjami - hochberg] = 0.037)。其他细胞类型,包括中性粒细胞、m1样巨噬细胞和Tregs,显示出改善OS的趋势,但没有达到显著性。使用队列中位数来定义tmc -高或低组有效分层患者结局(tmc -高中位OS: 24.3个月,tmc -低中位OS: 8.6个月。为了验证这种预测性生物标志物准确反映肿瘤内单核细胞RNA含量,而不是反褶积的技术伪影,将荧光活化细胞分选(FACS)分离的外周血单核细胞的RNA加入到食管癌活检中提取的RNA中,数量已知(占总RNA的0-8%),然后制备RNA-seq文库。增加的单核细胞RNA含量确实与增加的反卷积评估TMC显著相关。
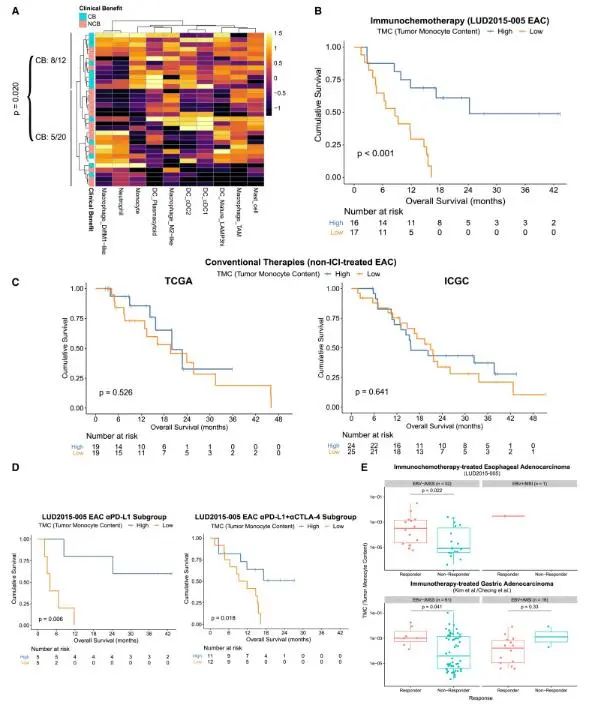
TMC增加是ICI+ ctx特异性预后改善的预测因子
事实上,虽然tmc -低肿瘤在ci - 4w时保留TAM/ m2样骨髓表型,但在tmc -高肿瘤中,ICI产生了更促炎的骨髓表型,在ci - 4w时,ICI向m1样巨噬细胞、cDC1s、cDC2s和成熟的lamp3 -高dc细胞转变。这些分化的效应物具有各种可能增强抗肿瘤反应的特征。m1极化巨噬细胞在吞噬后能够更好地溶解内化细胞,有助于改善肿瘤控制。LUD2015-005图谱中的m1样巨噬细胞也显示可增强抗肿瘤炎症反应的分泌蛋白表达增加,包括IL1A/IL1B和TNF。列出的DC亚群通过抗原呈递和共刺激信号帮助激活T细胞反应。XCR1+ cDC1s在MHC I上交叉呈递肿瘤抗原以激活抗肿瘤细胞毒性T细胞中发挥关键作用,在我们的数据集中和成熟的高lamp3的dc中,CD80/CD86共刺激信号的表达最高,需要完全激活T细胞反应。cDC2细胞在表型和功能上是异质的,但在指导肿瘤中的CD4应答中也起着重要作用。因此,ci诱导的高tmc肿瘤骨髓表型转移可以通过直接和T细胞介导的机制增强对治疗的抗肿瘤反应。在tmc -高患者中,ICI产生的炎性髓系效应物可能与ICI诱导的淋巴细胞浸润共同作用,推动改善的ICI- 4w肿瘤缩小和总体ICI+CTX结果。
最后,我们展示了scRNA-seq识别细胞类型特异性预测性生物标志物的能力。虽然患者数量有限(n = 8),但scRNA-seq的特异性使我们能够发现由于细胞间不同的表达模式而在大量转录组学中被掩盖的基因。在prex EAC细胞中,IGFBP2与CB的相关性最为显著。IGFBP2在黑色素瘤中的肿瘤特异性表达与ICI有利的免疫环境有关,表明该方法可以成功地揭示细胞类型特异性表达模式的有意义的生物学信号。在T细胞中,在对ICI (INCITE-quiescence)缺乏炎症反应的NCB患者中发现了高prex ISG表达。虽然ISG可以介导免疫应答,但在严重病毒感染(包括HIV和SARS-COV-2)期间,它们在T细胞中的异常过表达与T细胞功能障碍和死亡有关,这些功能障碍和死亡是通过ISG介导的,包括促凋亡的XAF1。因此,T细胞特异性ISG表达可以作为功能障碍或易凋亡的T细胞不太可能对ICI作出反应的标志,这与在这些患者中观察到的incte -静止一致。这些发现需要进一步验证,但显示了scRNA-seq如何揭示额外的预测性生物标志物和生物学见解。
这些及时的发现扩展了我们对EAC中ICI反应的理解。在这种情况下,TMC和TMB标志着患者可能从ICI+CTX治疗中获益,并有助于为EAC患者的选择策略提供信息,以及ICI+CTX治疗的其他越来越多的癌症。
参考资料:
https://www.science.org/doi/10.1126/sciimmunol.add4817

