导读:信使RNA(mRNA)疫苗正在彻底改变癌症免疫方法。然而,mRNA免疫受到多阶段生物屏障的极大限制,包括淋巴转运不良,快速清除,催化水解,细胞进入不足和内体捕获。
8月11日,中国科学院上海药物所李亚平研究员、郑明月研究员和上海交通大学医学院王当歌研究员在《 National Science Review》期刊发表了题为“STING agonist-boosted mRNA immunization via intelligent design of nanovaccines for enhancing cancer immunotherapy” 的研究论文。该研究利用机器学习手段指导纳米疫苗的理性化设计,使其兼具高树突状细胞靶向性和高mRNA抗原呈递效率,实现mRNA抗原和环二核苷酸类STING激动剂的高效协同递送,提高了癌症免疫治疗效果。
https://academic.oup.com/nsr/advance-article/doi/10.1093/nsr/nwad214/7241542?login=false
研究背景
01
信使RNA(mRNA)疫苗正在彻底改变各种疾病的治疗。mRNA疫苗可在短时间内灵活开发,允许多种抗原的瞬时表达,实现安全高效的免疫效果。多种mRNA疫苗正在临床实验中,其中两种疫苗已获得美国食品和药物管理局 (FDA) 的授权,用于对抗 COVID-19。然而,在开始强免疫之前,mRNA疫苗的临床转化仍然受到多阶段递送障碍的阻碍。首先,mRNA快速清除进入循环并显示淋巴管不良,通过皮内给药运输。二、间隙质催化水解空间导致mRNA的细胞靶向不足。第三,细胞膜和内体的磷脂双层限制了mRNA进入细胞质。最后,在没有佐剂的情况下,单独接种mRNA几乎不能诱导强烈的免疫反应。提高mRNA的胞质递送和促进其体内疫苗接种效果仍然具有挑战性。
研究设计
02
该研究建立了基于纳米载体数据库(2010-2021,web of science)的机器学习模型,确定了高效递送mRNA和cGAMP的纳米疫苗的关键参数,制备了基于苯硼酸接枝聚乙烯亚胺的mRNA/cGAMP 纳米复合物,并进一步包被阴离子脂质材料获得该纳米疫苗:1)纳米疫苗的表面负电荷减少了与基质中带负电糖胺聚糖的作用,提高纳米疫苗在淋巴结蓄积;2)纳米疫苗被淋巴结内抗原呈递细胞(APCs)摄取后,促进mRNA和cGAMP从内体向胞质释放,有效激活STING通路并诱导APCs呈递肿瘤抗原;3)STING通路的激活促进IFN-I的释放,激活T细胞免疫应答,杀伤肿瘤细胞,抑制肿瘤细胞生长和转移。与单独mRNA疫苗相比,基于该纳米疫苗的治疗策略在黑色素瘤和结直肠癌模型中展现出更强的抗肿瘤效果。
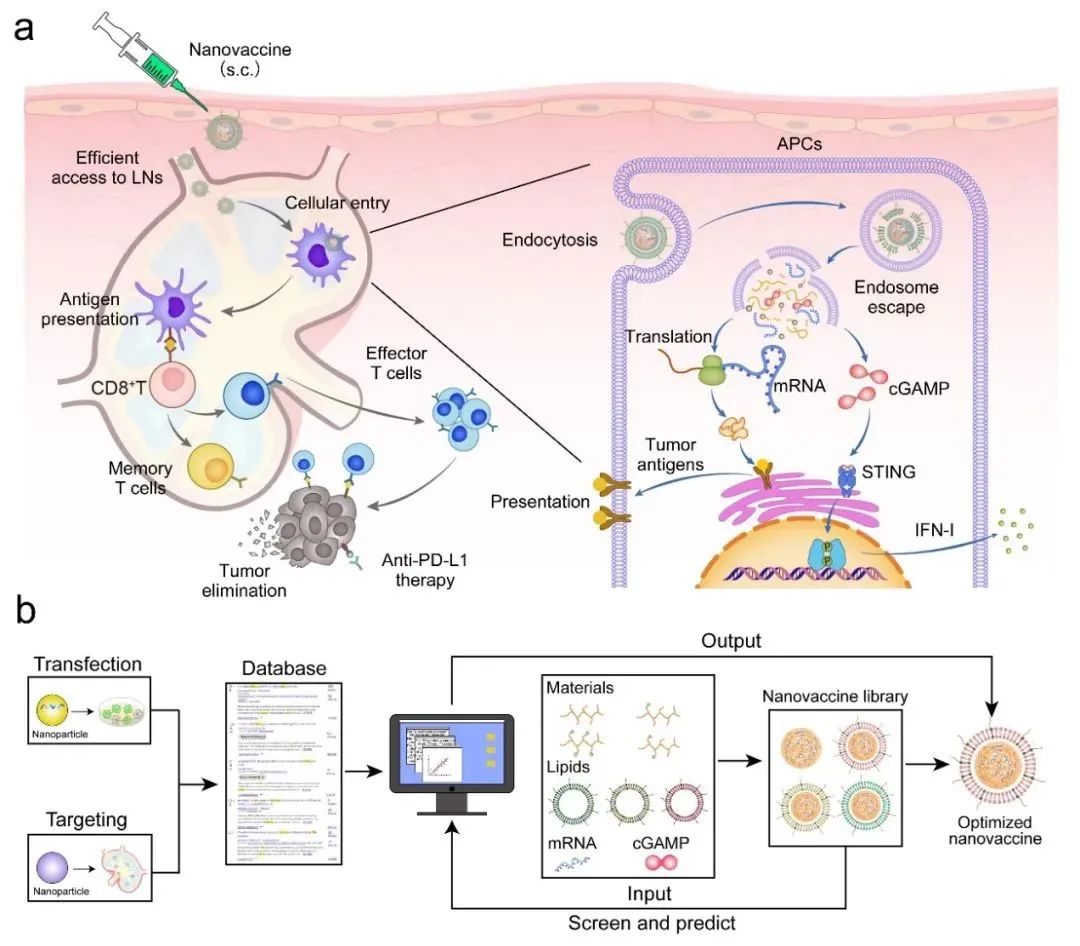
纳米疫苗的作用原理及机器学习指导纳米疫苗设计
研究意义
03
研究过程中,我们设计了一种基于智能设计的mRNA纳米疫苗来克服mRNA疫苗研发的相关障碍。利用来自各种纳米载体数据集的机器学习技术进行高效纳米疫苗研发,确保将mRNA抗原和环鸟苷单磷酸腺苷(cGAMP)成功递送到靶标。它激活干扰素基因(STING)的刺激物,促进mRNA编码的抗原呈递并增强体内抗肿瘤免疫力,从而抑制肿瘤生长并确保荷瘤小鼠的长期存活。
总之,本工作为促进STING激动剂协同mRNA免疫提供了一种可行且安全的策略,对增强癌症免疫治疗具有巨大的转化潜力。
参考资料:
https://academic.oup.com/nsr/advance-article/doi/10.1093/nsr/nwad214/7241542?login=false
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。

