导读:在许多肿瘤中观察到大量肿瘤相关巨噬细胞(TAM)浸润,其通常显示免疫抑制性M2样表型,但由于其高度可塑性,也可以转化为M1样抗肿瘤表型。巨噬细胞极化状态与细胞形状的变化有关,巨噬细胞形态与活化状态有关。M1巨噬细胞看起来大而圆,而M2巨噬细胞是拉伸和细长的细胞。操纵细胞形态已被证明会影响巨噬细胞的极化状态。细胞的形状在很大程度上取决于细胞骨架蛋白,尤其是微管。作为一种微管靶向药物,长春花碱(VBL)已被用于化疗。然而,迄今为止还没有研究探讨VBL对TAM形状变化的影响及其在肿瘤免疫反应中的作用。
8月31日,上海交通大学王静研究员团队在《Journal for Immuno Therapy of Cancer》上发表研究论文“Vinblastine resets tumor-associated macrophages toward M1 phenotype and promotes antitumor immune response”,探讨了操纵细胞形态是否会影响巨噬细胞极化,从而诱导抗肿瘤反应。另外,研究数据揭示了VBL以前未被识别的抗肿瘤机制,并提出了一种将VBL与免疫检查点抑制剂相结合的药物再利用策略,以改善恶性肿瘤免疫治疗。

https://jitc.bmj.com/content/11/8/e007253
研究背景
01
巨噬细胞是结直肠和肺部肿瘤微环境中最常见的细胞之一,但它们在免疫治疗过程中的动态变化尚不完全清楚。浸润肿瘤微环境的巨噬细胞被认为是肿瘤相关巨噬细胞(TAM)。成熟的巨噬细胞通常表现出两种表型之一,包括经典活化(M1样)和交替活化的巨噬细胞(M2样)。TAM通常表现出M2样表型,通过形成免疫抑制微环境来加速肿瘤的发展和转移。研究表明,M1样巨噬细胞可以通过抗原呈递或促炎细胞因子的分泌来激活细胞毒性T淋巴细胞,导致T细胞增殖和IFNγ分泌。因此,M1 TAM被认为是抑制肿瘤的巨噬细胞。 值得注意的是,巨噬细胞是高度可塑性的细胞,其功能可以发生显著变化。正在开发的治疗方法旨在重新增强TAMs的抗肿瘤免疫机制,以增加肿瘤细胞的吞噬作用。
细胞形态学作为细胞功能的强大综合生物标志物最近受到越来越多的关注。根据先前在小鼠和人类研究中的观察,巨噬细胞形态与活化状态有关;M1巨噬细胞看起来大而圆,而M2巨噬细胞是拉伸和细长的细胞。 操纵细胞形态已被证明会影响巨噬细胞的极化状态。McWhorter等人通过在宽度为2μm的微图案凹槽上诱导细胞形成细长形态,成功地将鼠骨髓衍生巨噬细胞(BMDMs)极化为M20表型。细胞的形状在很大程度上取决于三组细胞骨架蛋白丝:微管,中间丝和肌动蛋白丝。破坏微管已被证明可以诱导巨噬细胞系中细胞形状和细胞体积的变化。Cao等发现微管抑制剂卡巴他赛通过NF-kB信号激活促进巨噬细胞向M1状态极化,从而增强对三阴性乳腺癌细胞的消除。这些结果表明,靶向巨噬细胞是一种有前途且有效的肿瘤治疗策略。其他靶向微管的药物已被用作抗肿瘤化疗药物,但其在调节肿瘤免疫应答中的作用和作用机制仍处于起步阶段,因此需要进一步研究。
研究设计
02
我们使用细胞骨架的荧光染色和定量分析来揭示M0,M1,M2,TAM和VBL处理的TAM之间的形态差异。流式细胞术用于使用基于细胞表面标记的分类来确认这些巨噬细胞的极化状态。在肿瘤小鼠模型中进行体内抗体去除实验,以测试巨噬细胞和CD8 T细胞群是否需要VBL的抗肿瘤作用。然后研究了VBL和抗PD-1联合疗法与单药治疗的比较。对VBL处理和未处理的TAM进行RNA-seq分析,探讨通路活性的变化。进行siRNA介导的敲低实验以验证受VBL处理影响的靶途径。
研究结果
03
长期以来,VBL的抗肿瘤作用一直归因于通过靶向微管解聚来抑制肿瘤细胞分裂,但VBL的免疫调节作用长期以来一直被忽视。我们的研究提供了新的证据,证明VBL的抗肿瘤作用通过将M2样TAM重新编程为M1样抗肿瘤表型并随后通过NF-κB-Cyba-ROS轴激活CD8 T细胞(图8)来促进肿瘤中的免疫应答。
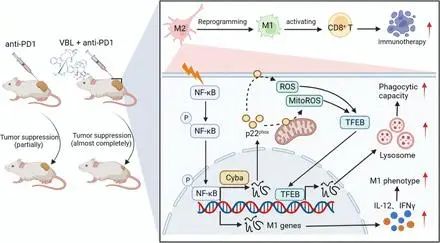
VBL介导的抗肿瘤免疫反应的工作模型。VBL磷酸化并激活TAM中的转录因子NF-κB,上调编码p22phox蛋白表达的cyba。p22phox催化合成提高了胞质ROS和MitoROS水平。ROS进一步促进了转录因子TFEB进入细胞核,加速溶酶体的生物发生和活化,从而赋予TAM更高的吞噬能力。ROS还将TAM重新极化为M1样表型,并消除了它们对CD8 T细胞的抑制活性。
综上所述,本研究表明VBL(一种破坏微管稳定性的抗肿瘤剂)在体外和肿瘤模型中都驱动巨噬细胞极化为M1样表型。VBL的抗肿瘤作用在没有巨噬细胞或CD8 T细胞的情况下减弱。在机制上,VBL诱导NF-κB和Cyba依赖性活性氧的激活产生,从而使TAM极化为M1表型。同时,VBL促进转录因子EB的核易位,诱导溶酶体生物发生和巨噬细胞吞噬活性的显著增加。
总的来说,当前的研究探讨了控制巨噬细胞形态是否可以在肿瘤背景下引发活化状态和细胞反应的改变。VBL通过NF-κB-Cyba-ROS轴将巨噬细胞重编程为M1样表型,然后激活CD8 T细胞以抑制肿瘤生长,从而在与抗PD-1单克隆抗体组合时增强免疫治疗。本研究结果定义了VBL用于癌症治疗的新型免疫调节作用机制,突出了一种新的联合治疗策略治疗恶性肿瘤的潜力。
参考资料:
https://jitc.bmj.com/content/11/8/e007253
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。

