导读:癌细胞发展多种策略来逃避T细胞介导的杀伤。一方面,癌细胞可能会优先依赖某些氨基酸进行快速生长和转移。另一方面,足够的营养物质供应和摄取对于在肿瘤微环境(TME)中发挥有效的T细胞抗肿瘤反应是必要的。
2月15日,中国医学科学院苏州系统医学研究所张连军、苏州大学附属第二医院张力元和西安交通大学基础医学院张保军共同通讯在期刊《Cell Death & Disease》上在线发表题为“Cystine deprivation triggers CD36-mediated ferroptosis and dysfunction of tumor infiltrating CD8+T cells”的研究论文,研究结果揭示了肿瘤细胞对胱氨酸的竞争导致T细胞免疫功能受损。研究人员阐明了肿瘤浸润T细胞中铁死亡的新机制:胱氨酸匮乏导致谷氨酸积累,进而加剧CD36介导的脂质过氧化物产生。这些发现为靶向氨基酸代谢或CD36阻断的免疫治疗策略提供了理论基础。研究人员证明提高Gclc表达能保护T细胞免受胱氨酸匮乏引起的损伤,为改造T细胞以实现有效的抗肿瘤免疫治疗提供了潜在策略。

https://www.nature.com/articles/s41419-024-06503-1
研究背景
01
过继性T细胞转移和免疫检查点阻断已经在某部分癌症患者中取得了持久的临床效果,但大多数患者由于高度免疫抑制的肿瘤微环境(TME),无法从这些治疗中获益,这对于有效治疗实体肿瘤的免疫疗法构成了重大挑战。
在TME中,多种因素导致免疫抑制,包括低氧和pH水平、有限的营养物质供应(如葡萄糖、脂肪酸和氨基酸)、免疫抑制代谢产物积累(如ROS、乳酸和脂质)以及免疫抑制性细胞因子和趋化因子的增加分泌。在这方面,T细胞逐渐失去记忆或干细胞特性的能力,并向衰竭和功能障碍的方向分化。这表现为TCF1、LY108和CD62L的表达减少,以及PD-1、TIM-3和TOX等衰竭标志物水平升高。
研究发现
02
在这项研究中,研究人员证明CD8+T细胞无法与肿瘤细胞竞争胱氨酸摄取,导致胱氨酸饥饿。胱氨酸匮乏诱导氧化应激和谷氨酸积累,从而上调CD36介导的脂质摄取。这个过程导致T细胞耗竭和铁死亡,表现为TCF1、LY108和CD62L表达的减少,伴随PD-1和TIM-3表达的增加,氧化应激和脂质积累的增加。胱氨酸匮乏的T细胞的细胞因子分泌,包括IFNγ、TNFα和IL-2,也有所下降。为了改善胱氨酸饥饿下T细胞的抗肿瘤能力,研究人员构建了表达谷胱甘肽合成限速酶Gclc的T细胞。Gclc是细胞内抗氧化剂的关键调节因子,最近的研究报告显示它通过消耗胱氨酸缺乏的肿瘤细胞中的谷氨酸来对抗铁死亡。这些观察结果暗示了Gclc在缺乏胱氨酸的TME下保护T细胞存活和功能的潜力。Gclc过表达通过谷胱甘肽合成和谷氨酸消耗增强T细胞的抗肿瘤功能。研究发现揭示了肿瘤在肿瘤微环境中诱导免疫抑制的新机制,并强调通过调节胱氨酸的可用性来提升T细胞的抗肿瘤免疫治疗潜力。
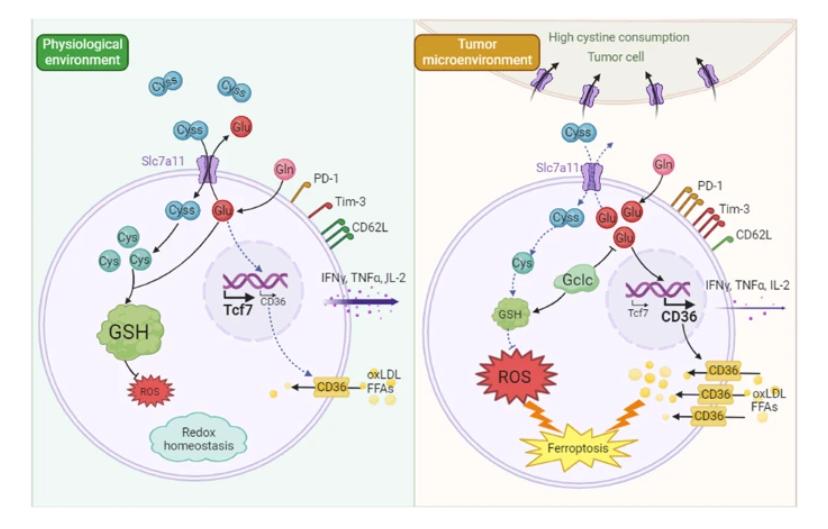
研究结果
03
综上所述,研究结果揭示了肿瘤细胞对胱氨酸的竞争导致T细胞免疫功能受损。研究人员阐明了肿瘤浸润T细胞中铁死亡的新机制:胱氨酸匮乏导致谷氨酸积累,进而加剧CD36介导的脂质过氧化物产生。这些发现为靶向氨基酸代谢或CD36阻断的免疫治疗策略提供了理论基础。研究人员证明提高Gclc表达能保护T细胞免受胱氨酸匮乏引起的损伤,为改造T细胞以实现有效的抗肿瘤免疫治疗提供了潜在策略。
参考资料:
https://www.nature.com/articles/s41419-024-06503-1
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。

