恶病质影响50-80%的癌症患者,占癌症相关死亡的20%,但驱动恶病质的潜在机制尚不清楚。
2024年3月18日,北京大学肖瑞平及胡新立共同通讯在Nature Metabolism 在线发表题为“Activation of GPR81 by lactate drives tumour-induced cachexia”的研究论文,该研究发现在患有癌症恶病质的男性和女性患者以及临床相关的小鼠模型中,循环乳酸水平与体重减轻程度呈正相关。
乳酸输注本身足以在无肿瘤小鼠中以剂量依赖的方式触发恶病质表型。此外,还证明脂肪特异性G蛋白偶联受体(GPR)81消融,与全局GPR81缺乏类似,可以改善雄性小鼠乳酸诱导或肿瘤诱导的脂肪和肌肉消耗,揭示脂肪GPR81是乳酸分解代谢作用的主要介质。在机制上,乳酸/GPR81诱导的恶病质发生独立于已建立的蛋白激酶A分解代谢途径,但它是由信号级联顺序激活Gi-Gβγ-RhoA / ROCK1-p38介导的。这些发现突出了靶向GPR81治疗这种危及生命的癌症并发症的治疗潜力。

恶病质的特点是体重迅速减轻,约占癌症相关死亡的20%。癌症恶病质患者会出现虚弱、厌食、贫血和疲劳,导致生活质量下降,对癌症治疗的耐受性差。虽然癌症恶病质例证了一个突出的未满足的医疗需求,其潜在的机制知之甚少。
脂肪和肌肉的减少是恶病质的主要表现。几种炎症细胞因子,如肿瘤坏死因子(TNF)、白细胞介素(IL)-6、转化生长因子-β和干扰素(IFN)-γ,都与刺激脂肪和肌肉重构有关,这些脂肪和肌肉重构是由癌细胞的旺盛生长引起的。它们被认为是癌症恶病质发病的主要驱动因素。然而,多项抗炎治疗的临床试验结果令人失望,这表明靶向炎症细胞因子不足以治愈癌症恶病质。迄今为止,在肿瘤生物学和医学领域仍然存在一个基本的知识缺口,即肿瘤与宿主代谢失调之间的联系
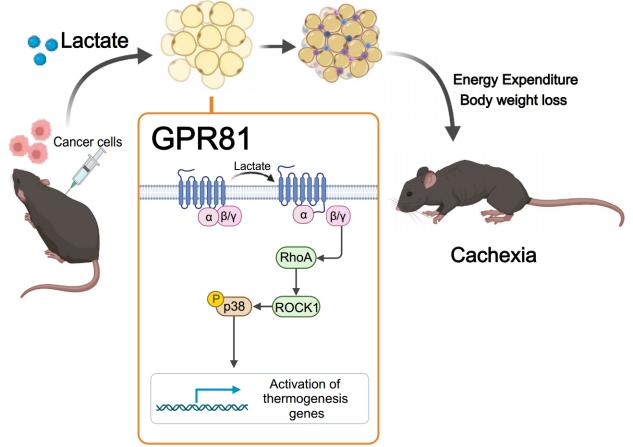
文章模式图(图源自Nature Metabolism )
综上所述,该研究揭示了乳酸对GPR81的慢性激活可以通过Gαi/ o-Gβγ-RhoA / ROCK1-p38信号级联促进脂肪褐变和脂肪分解,从而促进肌肉营养不良和全身高分解代谢。因此,靶向GPR81及其关键信号成分有望对抗癌症恶病质代谢损伤,从而改善恶病质患者的生活质量和寿命。

