6月26日,复旦大学中山医院研究团队在期刊《Cell Death Discovery》上发表了研究论文,题为“Mobilization and activation of tumor-infiltrating dendritic cells inhibits lymph node metastasis in intrahepatic cholangiocarcinoma”。本研究发现,肿瘤细胞内源性β-连环蛋白激活是ICC中LNM时破坏DC介导的抗肿瘤免疫的关键机制。FL-pIC疗法或β-连环蛋白抑制剂可能值得作为一种潜在的方案来缓解ICC细胞向LN的转移并实现有效的肿瘤免疫控制。

https://www.nature.com/articles/s41420-024-02079-z#Sec9
研究背景
01
肝内胆管癌(ICC)约占原发性肝癌的10-20%,在过去20年中全球范围内的发病率和死亡率均呈上升趋势。手术切除是ICC唯一的潜在治愈方法,但术后5年生存率仍然很低,主要是由于肿瘤复发率较高。其中,淋巴结转移(LNM)是ICC患者进行根治性切除后最常见的风险因素之一,已被证实与快速肿瘤复发和不良长期生存有关。根据美国联合委员会癌症分期系统(AJCC)第8版TNM分期方案,ICC中LNM的存在表明肿瘤处于更晚期。然而,肿瘤向淋巴结转移的分子机制尚不为人所知。对肿瘤微环境的全面分析有助于加深我们对LNM机制的理解,并为ICC设计更有效的抗癌疗法。
研究进展
02
研究人员将TLR3激动剂聚肌胞(poly(I:C))与Flt3L联合使用,促进Flt3L动员的DCs的成熟和激活。研究人员首先探索是否可以使用MuCCA1细胞构建足垫肿瘤LNM模型。然而,在第35天和第85天的体内动态成像显示,MuCCA1细胞的LNM潜力有限,因此不适合构建LNM模型,这可能是由于缺乏β连环蛋白信号激活的证据,即膜β连环蛋白IF染色。然后,研究人员转向了另一种从AKT/YAP诱导的ICC中建立的细胞系mIC-23,发现mIC-23细胞可以构建肿瘤LNM模型。此外,在AKT/YAP驱动的ICC病变和mIC-23足垫肿瘤中进行的YAP和β连环蛋白的IF染色显示,YAP和β连环蛋白同时在核内共定位,提示两者信号的完全激活。
研究人员接下来在体内使用mIC-23足垫肿瘤LNM模型研究联合FL-pIC疗法的治疗效果。将荧光素酶(Luc)-标记的mIC-23细胞植入足垫区域后,研究人员将小鼠随机分为2组(每组9只),并接受相应的治疗。体内生物荧光成像显示,与PBS组相比,FL-pIC疗法显著抑制了mIC-23肿瘤细胞向腘窝LN的转移。研究人员取出主要足垫肿瘤、腘窝LN和腹股沟LN。同样,FL-pIC治疗抑制了mIC-23足垫肿瘤的生长。研究人员还观察到与对侧正常LN相比,肿瘤引流的腘窝LN体积更大。腘窝LN的H&E染色和CK19免疫组化染色进一步证实,FL-pIC疗法显著抑制了LN转移,而不影响肿瘤引流的腘窝LN的大小。此外,腘窝LN的IF染色显示,转移的mIC-23细胞的核内有YAP和β-连环蛋白的阳性染色。
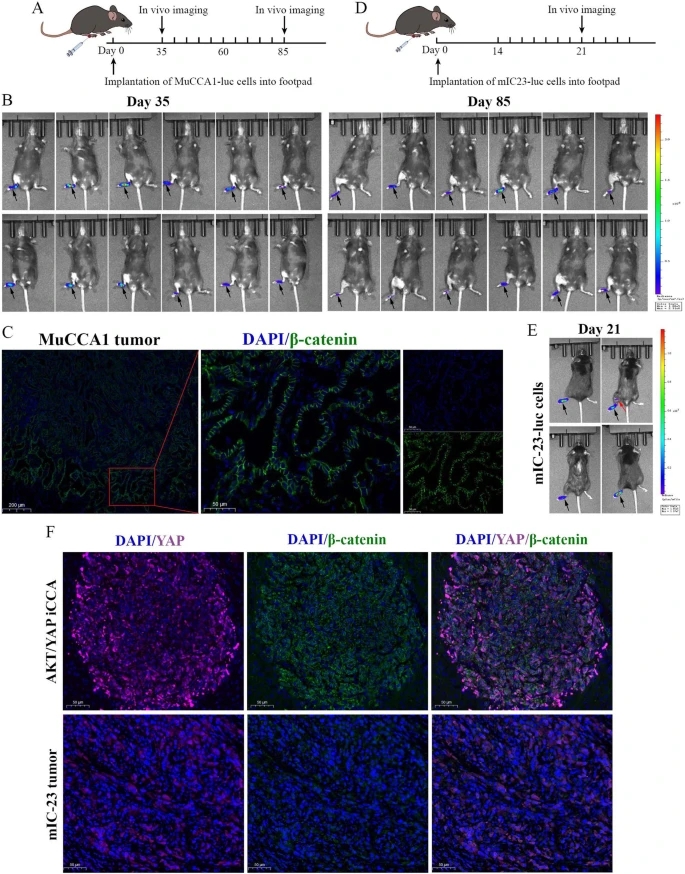
利用小鼠ICC细胞系构建足垫肿瘤LNM模型的探索
研究结论
03
综上,研究结果表明,β-连环蛋白激活导致DC被排斥进入ICC肿瘤微环境,并通过阻断CXCL12的产生来实现。在肿瘤内扩张和激活cDCs代表了一种有前途的治疗策略,有助于减轻肿瘤细胞向LNs的转移。

