肿瘤免疫治疗是一种新兴的肿瘤治疗手段。目前,临床应用较为广泛的免疫治疗疗法均是以提高T细胞抗肿瘤功能为主的,包括基因工程T细胞治疗和免疫检查点治疗等。近年来,以PD-1为代表的免疫检查点治疗在实体肿瘤治疗中取得了令人惊喜的临床疗效;以CAR-T为代表的基因工程T细胞治疗在血液肿瘤和部分实体肿瘤中也获得了良好的临床疗效。然而,尽管这些免疫治疗手段在临床中具有一定的效果,仍然存在大部分肿瘤患者不能获益。随着免疫治疗基础研究的不断深入,现有的免疫治疗手段在实体肿瘤中疗效欠佳的主要原因之一为肿瘤微环境对T细胞的免疫抑制作用。因此,迫切需要探究肿瘤微环境中T细胞抗肿瘤功能失调的因素,开发免疫治疗新靶点,进一步拓宽T细胞研究思路是建立新的治疗方法的重要基础。
T细胞是肿瘤免疫治疗的主力军。在肿瘤患者中,由于肿瘤微环境中各种免疫抑制细胞、免疫调节因子,以及代谢产物等失调,限制了T细胞抗肿瘤功能。大量研究均表明了肿瘤微环境中T细胞抗肿瘤功能下降受到多种因素调控,然而,肿瘤微环境中T细胞代谢调控因素尚不清晰,揭开肿瘤微环境中T细胞代谢调控的神秘面纱,能够为现有的肿瘤免疫治疗提供新的研究思路。
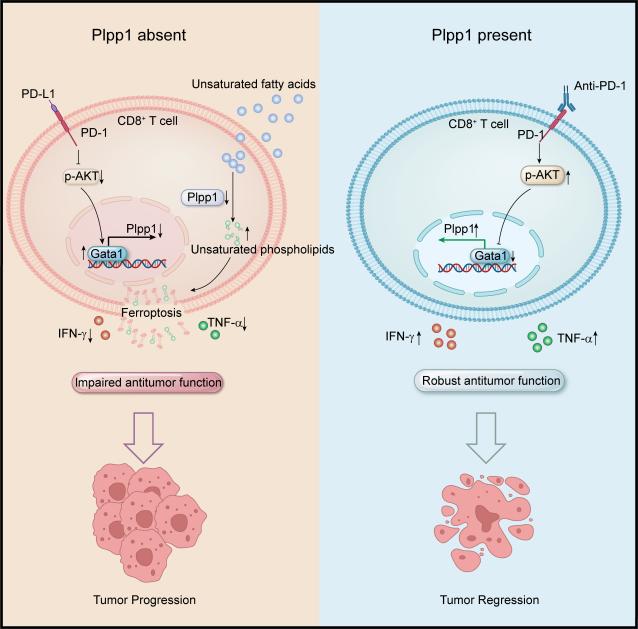
2024年8月28日,Cell Press细胞出版社旗下期刊Immunity在线发表了由中国科学家完成的PD1信号通路调控T细胞磷脂代谢的研究,题为“PD-1 signaling limits expression of phospholipid phosphatase 1 and promotes intratumoral CD8+ T cell ferroptosis”。 该研究利用脂质代谢组学发现PLPP1介导的磷脂代谢在肿瘤浸润CD8+ T细胞中异常,通过基因编辑小鼠及单细胞测序等技术报道了PLPP1缺失促进了肿瘤浸润CD8+ T细胞不饱和磷脂合成,造成T细胞铁死亡,且肿瘤浸润CD8+ T细胞PLPP1表达受PD-1信号通路调控,与PD-1单抗治疗疗效密切相关,这为改善肿瘤免疫治疗疗效提供了新靶点和新思路。
郑州大学第一附属医院生物细胞治疗中心/生物免疫治疗病区主任张毅教授为通讯作者。郑州大学第一附属医院生物细胞治疗中心助理研究员平玉、生物免疫治疗病区住院医师单吉琦、生物细胞治疗中心和郑州大学公共卫生学院博士生秦海名为共同第一作者。
为了研究肿瘤浸润CD8+ T细胞的脂质代谢的改变,研究人员使用脂质代谢组学分析了来自肿瘤微环境和外周血单个核细胞的CD8+ T细胞中的差异代谢物,通过文献检索和体外验证影响脂质代谢的关键性基因。构建基因编辑小鼠和收集临床标本,通过代谢组学和转录组学等,检测关键性基因对CD8+ T细胞磷脂代谢和抗肿瘤功能调控的具体机制。进一步通过小鼠实验、单细胞转录组学、临床标本验证和大数据分析,验证关键性基因与PD-1单抗治疗疗效的关联。
本研究首先通过脂质代谢组学发现,肿瘤浸润CD8+ T细胞磷脂分布异常,其中磷脂酰胆碱和磷脂酰乙醇胺含量下降。进一步通过临床样本和小鼠体内实验发现,磷脂磷酸酶PLPP1在肿瘤浸润CD8+ T细胞中显著下调,且PLPP1的下调与T细胞抗肿瘤功能基因低表达相关。其次,本研究构建了T细胞中PLPP1特异性敲除的基因编辑小鼠模型,对肿瘤组织中野生型和PLPP1敲除的CD8+ T细胞进行转录组和代谢组分析,并进行了体内外实验验证,研究发现PLPP1缺失的CD8+ T细胞中不饱和磷脂含量增加,发生了铁死亡,进而其抗肿瘤功能下降。最后,研究还通过体外实验和动物实验发现了肿瘤浸润CD8+ T细胞中PLPP1的降低是由PD-1信号通路活化导致的,通过临床标本数据和单细胞测序验证CD8+ T细胞中PLPP1表达水平与PD-1单抗治疗疗效正相关。
本研究首次发现了肿瘤浸润CD8+ T细胞在PLPP1介导的磷脂合成异常情况下的脂质代谢状态,明确了肿瘤浸润CD8+ T细胞PLPP1降低,通过促进不饱和磷脂的含量导致细胞发生铁死亡,进而调控T细胞抗肿瘤功能的新机制,为理解肿瘤微环境T细胞抗肿瘤功能受损提供了新的研究视角;同时,证实了PLPP1下降主要由PD-1通路活化调控,且PLPP1高表达有利于提高PD-1单抗治疗效果。进一步提高T细胞PLPP1表达,为提高免疫治疗疗效提供了新靶点,开拓了新视角。
该研究得到国家自然科学基金委员会、科技部、河南省科技厅等的资助。
作者专访
Cell Press细胞出版社公众号特别邀请张毅教授进行了专访,为大家进一步详细解读。
CellPress:
细胞代谢在肿瘤免疫治疗领域的研究非常广泛,您认为本文章的研究亮点是什么?
张毅教授:
尽管越来越多的证据表明细胞代谢在肿瘤免疫中发挥至关重要的作用,但是磷脂作为细胞内表达丰度最高的一种脂质,在T细胞,尤其是肿瘤浸润T细胞中的分布情况仍是未知的。本研究利用脂质代谢组学全面解析了肿瘤浸润CD8+ T细胞磷脂代谢情况,发现细胞中磷脂酰胆碱和磷脂酰乙醇胺的下降;另外,通过本研究发现了PLPP1的缺失是介导T细胞不饱和磷脂形成的新机制,从而导致细胞铁死亡和抗肿瘤功能下降。我们的研究填补了目前肿瘤微环境T细胞磷脂代谢研究的空缺,同时揭示了调控T细胞铁死亡发生的新机制,具有较高的科学意义。
CellPress:
细胞脂质代谢是一个新兴的热门领域,您觉得本研究对免疫治疗有什么重要意义?
张毅教授:
近年来,国内外关于免疫治疗的基础研究和临床应用飞速发展,然而仍有大量患者不能获益,而这些免疫治疗,如免疫检查点抑制剂,对T细胞的影响机制值得进一步探讨。我们的研究发现了T细胞PLPP1受到PD-1信号通路调控,且PLPP1的高表达与PD-1单抗治疗疗效正相关。PLPP1作为肿瘤微环境T细胞代谢和功能调控的新分子,为提高免疫治疗效果提供了新的方法和策略。
CellPress:
基于本研究的发现,团队下一步的研究计划是怎样的?
张毅教授:
在本研究中我们利用基因编辑小鼠和临床标本探讨了PLPP1调控T细胞功能的内在机制,以及其在免疫治疗中的关键性作用,而过表达PLPP1对T细胞,及基因工程T细胞,比如CAR-T细胞的影响,现有的研究结果不够深入,在今后的研究中将会利用多种肿瘤模型重点验证过表达PLPP1是否能够优化CAR-T细胞的抗肿瘤功能;此外,我们团队同时在进行PLPP1激动剂的筛选,后续将进行动物实验验证。基于我们后续的研究计划,我们将在临床实验中进一步探讨PLPP1过表达的免疫细胞治疗或PLPP1激动剂联合免疫治疗的临床效果。

作者介绍

平玉
助理研究员
平玉,郑州大学第一附属医院生物细胞治疗助理研究员。研究方向:T细胞代谢与肿瘤免疫。主持国家自然科学基金-青年基金项目,中国博士后科学基金-面上项目,河南省中青年卫生健康科技创新人才-优青人才项目等;获得河南省科学技术进步奖一等奖。第一(含共同)作者身份研究成果发表在Immunity、Protein & Cell和Cancer Research等期刊。

张毅
教授
张毅,二级教授、国务院特殊津贴专家、中原学者。郑州大学第一附属医院首席科学家、郑州大学第一附属医院生物细胞治疗中心/生物免疫治疗病区主任。研究方向:肿瘤免疫治疗,长期致力于肿瘤免疫治疗基础研究和临床转化研究。担任中国免疫学会肿瘤免疫与生物治疗分会委员会主任委员、中国抗癌协会肿瘤生物治疗专委会副主任委员、中国细胞治疗质量管理和研究专委会常务副主任委员、中国研究型医院生物治疗学分会副主任委员、中国生物物理学会感染与免疫分会副会长、河南省抗癌协会/河南省免疫协会肿瘤免疫治疗专委会主任委员以及河南省细胞产业联盟理事长等。获得河南省自然科学一等奖、河南省科技进步一等奖、中国抗癌协会科技二等奖以及中国侨界贡献奖等。在Immunity、Nature immunology、Signal Transduction and Targeted Therapy、JCI等国际期刊发表SCI论文258篇。授权国家发明专利19项,转让7项,转让额超过8000万。
相关论文信息
论文原文刊载于Cell Press细胞出版社旗下期刊Immunity,点击“阅读原文”或扫描下方二维码查看论文
▌论文标题:
PD-1 signaling limits expression of phospholipid phosphatase 1 and promotes intratumoral CD8+ T cell ferroptosis
▌论文网址:
https://www.sciencedirect.com/science/article/abs/pii/S1074761324003765
▌DOI:
https://doi.org/10.1016/j.immuni.2024.08.003

