2024年12月4日,中国医科大学附属第一医院肿瘤外科王振宁教授团队在期刊《Cell Reports Medicine》上发表了题为“Interpretable multi-modal artificial intelligence model for predicting gastric cancer response to neoadjuvant chemotherapy”的研究论文。研究结果表明,与非反应者相比,反应者与肿瘤浸润边界的距离缩短,炎性细胞浸润增加。此外,应答者的CD11c表达升高。团队开发的分子病理学可解释模型,能准确预测化疗疗效。

https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(24)00619-0
深度学习与胃癌患者的新辅助化疗
01
基于深度学习的放射学和病理学模型在预测局部晚期胃癌患者的新辅助化疗反应和生存预后方面,已显示出前景。对多模态特征表征的探索,如将显微镜下的全滑动图像(WSI)与宏观计算机断层扫描(CT)对齐,以促进临床决策,仍然不够充分。此外,旨在分析WSI中的细胞成分,以解读局部晚期胃癌患者化疗反应变化的深度学习方法的研究,也很罕见。
在这项研究中,团队开发了一种可解释的人工智能框架,用于预测局部晚期胃癌患者对新辅助化疗的反应。该人工智能模型可解释细胞水平的基本特征如何影响用于预测化疗反应的CT特征提取。团队利用RNA测序(RNA-seq)和免疫组化(IHC),进一步验证了上述发现。
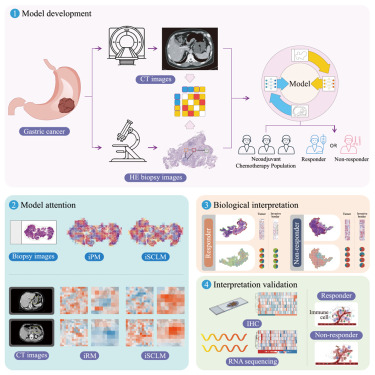
图形摘要
iSCLM专注于肿瘤浸润边界和炎症细胞比例
02
为了进一步探讨应答组和非应答组之间肿瘤浸润边界内病理图像的生物学差异,团队采用了HoVer-Net模型来识别切片的细胞含量。对于患者亚组之间iSCLM排名前10的切片,中炎性细胞/NEP、结缔组织细胞/NEP和坏死细胞/NEP的比例,存在显著差异。与此同时,非肿瘤性上皮细胞/NEP的比率,没有明显差异。一项旨在评估HoVer-Net结果可重复性的验证实验表明,HoVer-Net与人工计数和另一种自动细胞分类方法(TSFD-Net)的结果,具有很强的一致性。
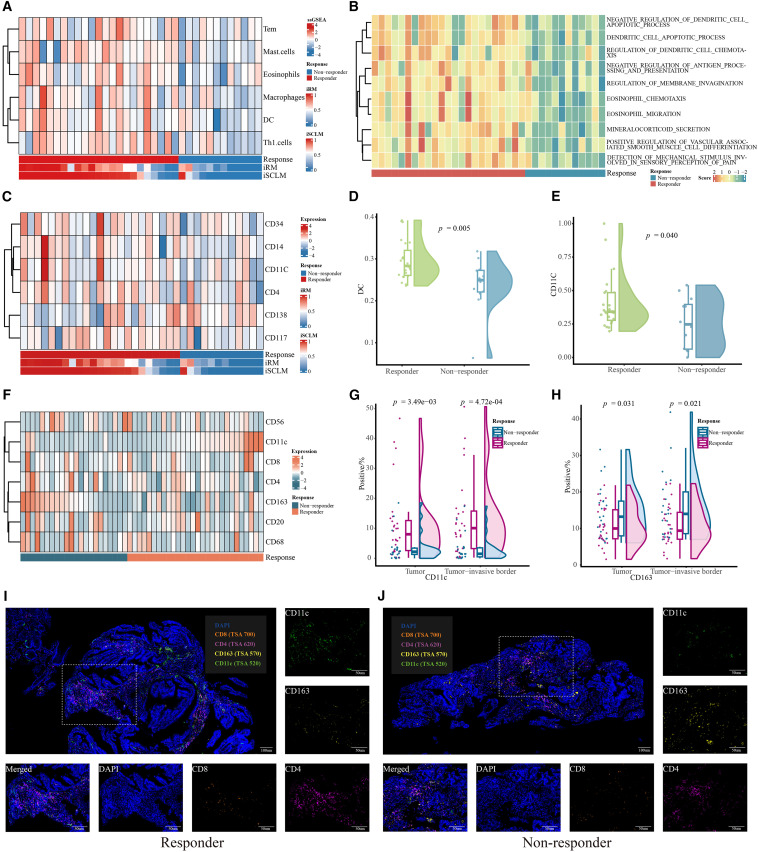
RNA-seq和IHC结果
iSCLM的预后价值及其对现实世界的影响
03
经过倾向评分匹配后,预测的应答者治疗组显示出最有利的结果(5年生存率:53.6%)。与预测无应答未治疗组相比,预测无应答治疗组的结果较差(5年生存率:25.9% 对 43.4%)。
接受基于iSCLM建议的治疗决策,可提高总生存率。接受iSCLM建议组与拒绝iSCLM建议组的5年生存率,分别为48.6%和35.6%。
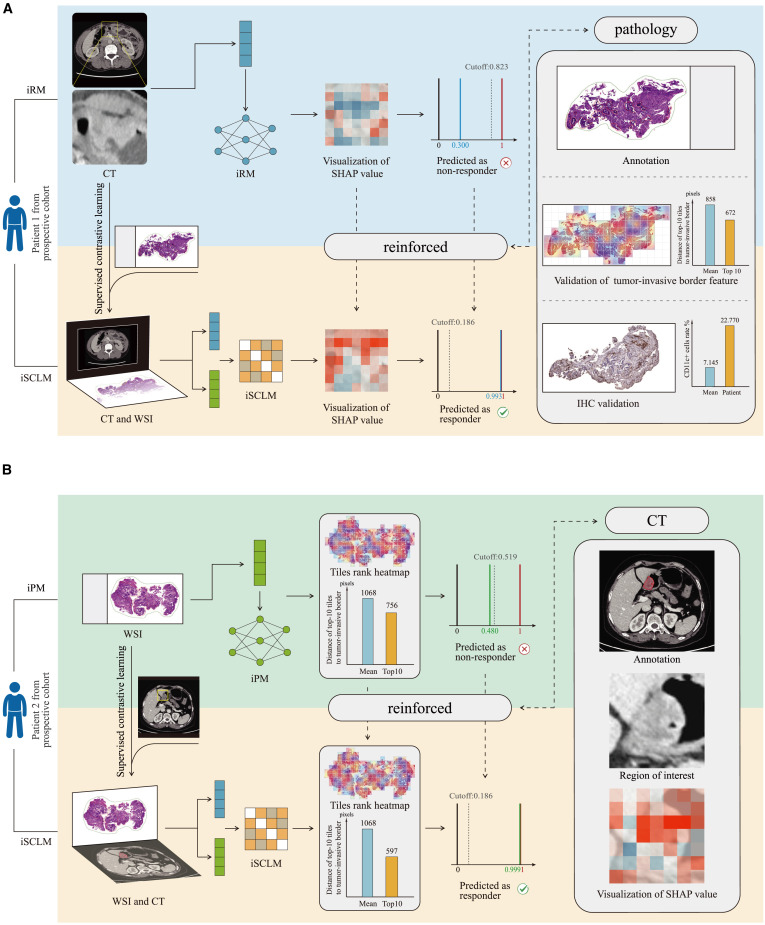
由于前瞻性队列中CT成像和病理学重点领域的变化,而导致的校正示例。
总结
04
1. iSCLM策略的优势:采用多模态iSCLM策略可以加强CT和病理图像的特征表示,特别是在肿瘤浸润边界处,这对于预测新辅助化疗反应至关重要。
2. 模型性能提升:与单模态模型和直接串联特征构建的模型相比,团队提出的模型在多中心队列中显示出显著的性能提升。
3. 治疗决策的生存益处:根据模型预测结果,接受治疗决策的患者5年生存率有显著差异,表明个性化指导可为患者带来生存益处。
4. 肿瘤浸润边界的炎性细胞含量:对新辅助化疗反应较好的患者,其肿瘤浸润边界内的炎性细胞含量更高,这揭示了潜在的生物学过程。
5. 免疫细胞组成的差异:RNA-seq和IHC分析显示,对新辅助化疗反应不同的患者在免疫细胞的组成,尤其是CD11c表达方面存在显著差异。
6. 研究的临床应用:开发的iSCLM模型能够准确预测新辅助化疗的疗效,其首要目的是改善生存预后,有助于推动临床实践,筛选适合新辅助化疗的局部晚期胃癌患者。
参考资料:
1.Smyth, E.C. ∙ Nilsson, M. ∙ Grabsch, H.I. ...
Gastric cancer
Lancet (London, England). 2020; 396:635-648
2.Joshi, S.S. ∙ Badgwell, B.D.
Current treatment and recent progress in gastric cancer
CA. Cancer J. Clin. 2021; 71:264-279

