Life science
2023年9月25日,武汉大学张金方团队在Cell Press细胞出版社期刊Cell Chemical Biology上发表了题为“Targeting METTL3 reprograms the tumor microenvironment to improve cancer immunotherapy”的研究成果。靶向PD-1/PD-L1的肿瘤免疫疗法的兴起,为肿瘤治疗领域带来了巨大的变革。然而,尽管这种疗法已经取得了一些成功,但仍然存在着一些患者对该疗法不响应或出现耐药的情况,其背后的机制尚待进一步探索。临床上,癌症患者肿瘤组织中免疫细胞浸润程度以及表达PD-L1的水平,与患者接受PD-1/PD-L1治疗响应率密切相关,因此探究免疫细胞和PD-L1表达的调控机制对提高免疫治疗响应率有着重要的意义。本研究发现在非小细胞肺癌(NSCLC)中,METTL3可以通过依赖m6A修饰的方式上调促癌型的趋化因子:CXCL1, CXCL5和CCL20,以及降解PD-L1的mRNA,进而促进非炎症性的肿瘤微环境形成(即冷肿瘤)(图1)。本研究通过多种临床前的动物模型,使用靶向METTL3的小分子抑制剂(STM2457),抑制其功能,将冷肿瘤微环境重编程为炎症性肿瘤微环境(即热肿瘤),使得NSCLC对抗PD-1免疫治疗更加敏感,为临床靶向PD-1/PD-L1免疫检查点联合治疗提供新的治疗策略。武汉大学张金方教授为论文通讯作者,俞海生、刘静、卜夏、马志强为论文共同第一作者。该研究获得了国家重点研发计划、国家自然科学基金委面上及青年项目、中央高校基本科研业务费专项资金、武汉市知识创新项目及湖北重点研发计划等的资助。
肿瘤免疫疗法的兴起为肿瘤治疗带来了巨大的推动力,然而在临床上仍然存在许多患者对该疗法不响应的情况。先前的研究将缺乏免疫细胞浸润和PD-L1低表达的肿瘤微环境被称为冷肿瘤,发现其对免疫治疗的响应性较差。因此,通过增加肿瘤微环境中的免疫细胞浸润以及提高PD-L1表达水平,使肿瘤微环境由冷转变为热,对提高免疫治疗的响应率具有重要意义。表观遗传修饰作为一个新兴的研究领域,在生理和病理过程中发挥着关键的调控作用。其中,m6A修饰作为真核生物中最广泛的一种RNA转录后修饰类型,在肿瘤发展过程中发挥着重要的调节作用。因此,针对m6A修饰过程进行干预,可能是提高肿瘤免疫治疗响应率的一种潜在策略。
近期鉴定的m6A修饰转移酶METTL3的特异性抑制剂STM2457已被报道可抑制急性髓细胞性白血病的进展,延长小鼠生存期,发挥抗癌作用。然而,关于STM2457是否能够调节肺癌的肿瘤微环境以提高免疫治疗效果,仍需进一步研究。张金方团队首次使用STM2457处理小鼠Lewis肺癌细胞系(LLC)并进行了RNA测序,分析了发生显著变化的信号通路和基因。结果显示,在STM2457处理下,趋化因子相关通路基因的RNA水平发生显著变化,其中促癌型趋化因子Cxcl1、Cxcl5和Ccl20的表达均明显下调(见图1)。已有研究表明CXCL1、CXCL5和CCL20能够招募免疫抑制性细胞,如MDSC细胞和Treg细胞,导致非炎症性肿瘤微环境的形成。进一步通过公共数据库中临床样本的测序数据分析发现,METTL3的表达与肿瘤中杀伤性免疫细胞CD8+ T细胞和NK细胞的浸润呈负相关,而与免疫抑制性细胞MDSC细胞和Treg细胞的浸润呈正相关。此外,在肺癌患者的癌组织切片中,检测到METTL3与CXCL1的表达呈正相关(见图2)。
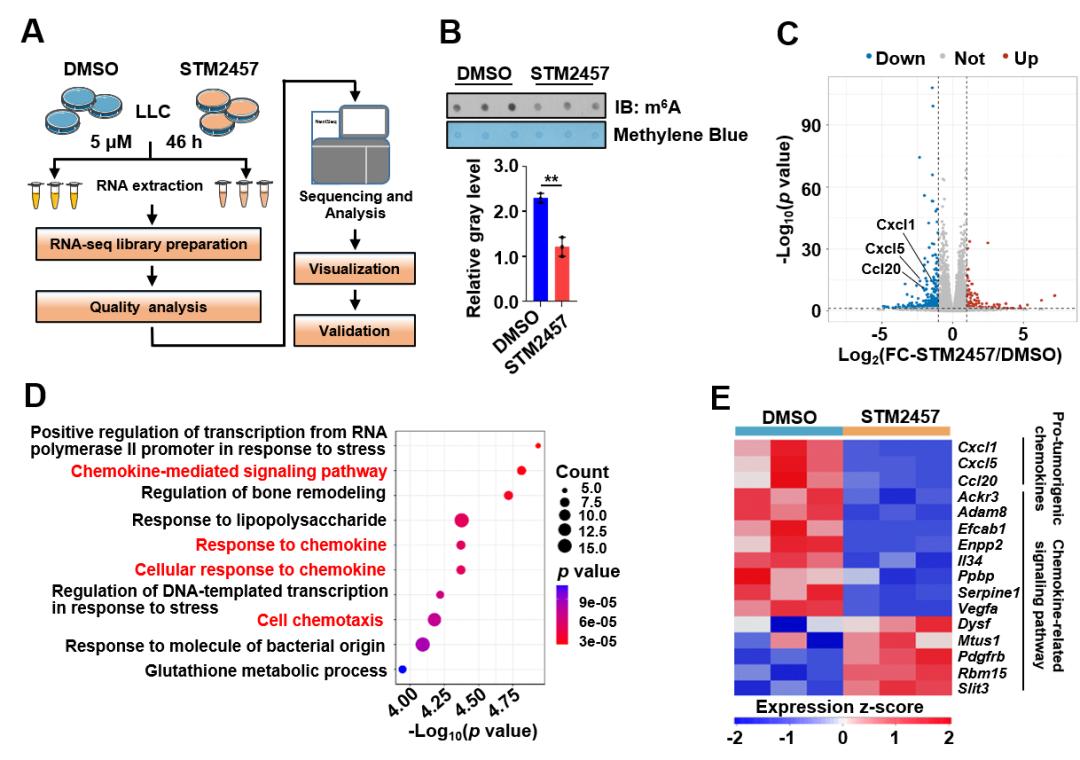
图1 RNA测序分析发现抑制METTL3功能,趋化因子相关通路发生显著变化。(A)RNA测序流程图;(B)METTL3抑制剂STM2457处理LLC细胞显著抑制了细胞的m6A修饰RNA水平;(C)火山图分析差异基因;(D)对差异基因进行通路富集发现多条趋化因子相关的通路;(E)对趋化因子相关基因进行热图分析。
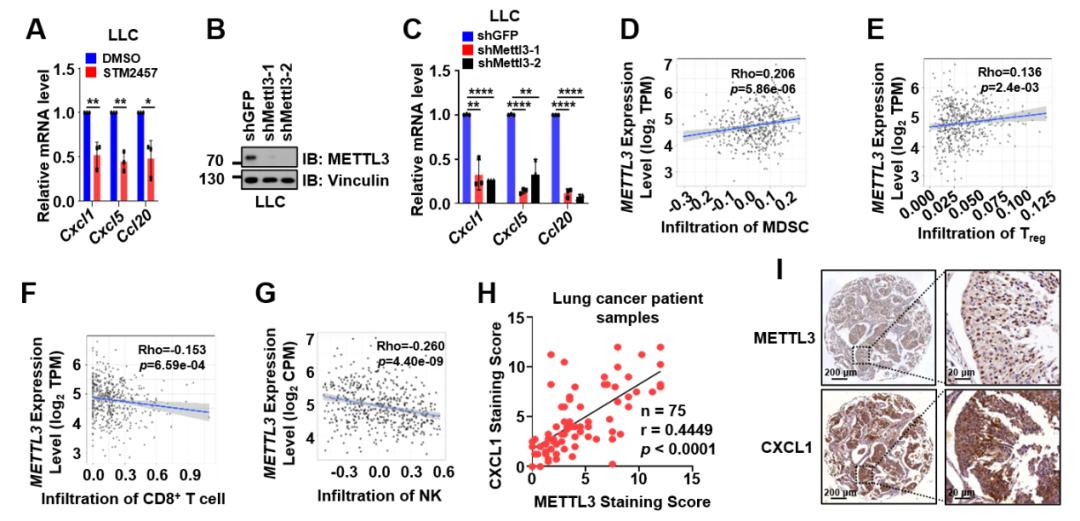
图2 METTL3与CXCL1、CXCL5和CCL20表达呈正相关。(A)STM2457下调Cxcl1、Cxcl5和Ccl20的RNA水平;(B)在LLC细胞中敲低METTL3;(C)敲低METTL3,Cxcl1、Cxcl5和Ccl20的RNA水平下调;(D-G)公共数据库分析METTL3与肿瘤浸润的MDSC细胞(D)Treg细胞(E)呈正相关,与CD8+ T细胞(F)和NK细胞(G)呈负相关;(H和I)肺癌患者肿瘤组织切片中METTL3与CXCL1表达呈正相关,染色结果中的代表性图片(I)。
接下来,研究者通过数据库预测调控趋化因子表达的转录因子,并与m6A修饰基因数据库进行比对,发现了三个潜在的调控趋化因子表达的转录因子:Pan2、c-Myc和Klf4。经过进一步排除后,确定METTL3通过介导c-Myc的m6A修饰来调控其表达,从而影响c-Myc下游的CXCL1、CXCL5和CCL20的转录及表达(见图3)。
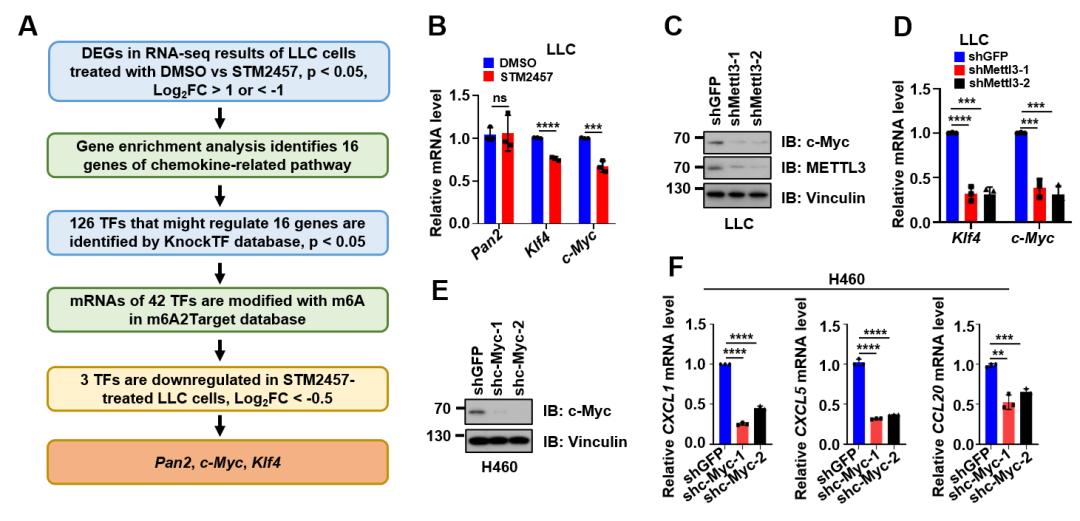
图3 METTL3通过c-Myc调控CXCL1、CXCL5和CCL20表达。(A)通过转录因子预测网站分析RNA测序结果中表达发生显著变化的趋化因子相关基因的上游转录因子,得到Pan2、c-Myc和Klf4三个候选基因;(B)STM2457处理之后,只有Klf4和c-Myc的mRNA水平发生显著性下调;(C)敲低METTL3后,c-Myc蛋白水平发生显著下调;(D)敲低Mettl3后,Klf4和c-Myc的mRNA水平发生显著性下调;(E和F)敲低c-Myc后(E),CXCL1、CXCL5和CCL20的mRNA水平发生显著下调(F)。
PD-L1作为肿瘤微环境分型的重要指标,其表达水平对免疫治疗的响应程度至关重要。先前的研究表明,PD-L1的mRNA可能受到m6A修饰的调控,但在肺癌中,m6A修饰对PD-L1表达的具体调控机制尚不清楚。因此,研究者通过对肺癌患者的肿瘤组织切片进行染色统计发现,METTL3与PD-L1的表达呈负相关。进一步实验表明,敲低METTL3以及STM2457处理均能显著上调肺癌细胞的PD-L1表达水平(见图4)。
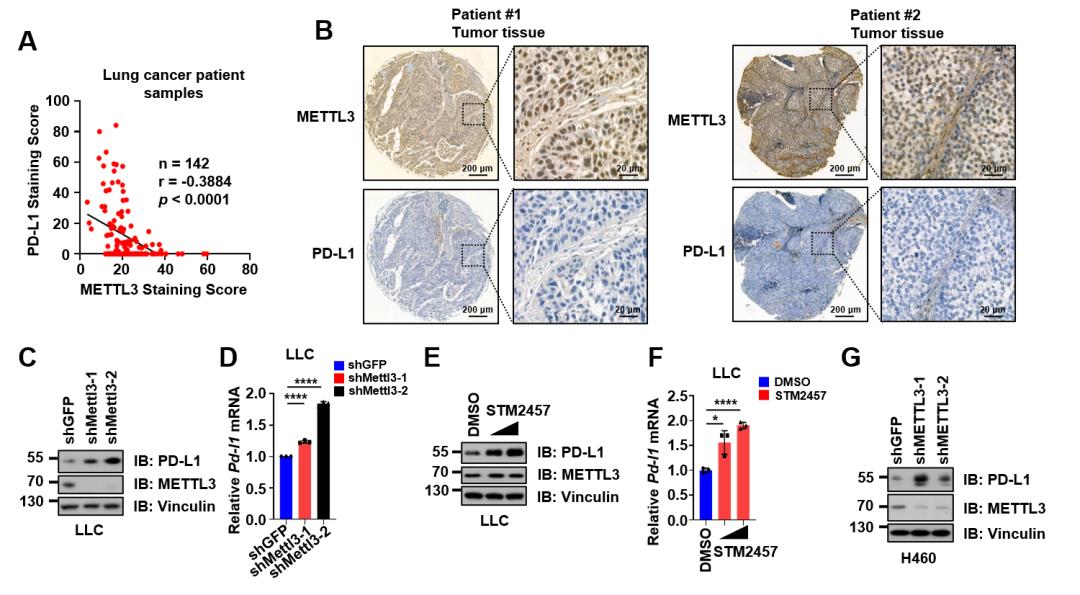
图4 在肺癌中,METTL3负调控PD-L1表达。(A和B)肺癌患者肿瘤组织切片中METTL3与PD-L1表达呈负相关(A),染色结果中的代表性图片(B);(C和D)在LLC细胞中,敲低Mettl3,PD-L1的蛋白水平(C)以及mRNA水平(D)都发生显著上调;(E和F)在LLC细胞中,加入STM2457处理,PD-L1的蛋白水平(E)以及mRNA水平(F)都发生显著上调;(G)在H460细胞中,敲低METTL3,PD-L1的蛋白水平发生显著上调。
最后,研究者通过在小鼠肺部原位接种LLC细胞,使用STM2457和PD-1抗体单独以及联合治疗。结果显示,联合治疗组中小鼠的肿瘤生长受到了最显著的抑制。此外,肿瘤组织中CXCL1、CXCL5和CCL20的表达明显下调,PD-L1的表达水平上调。同时,杀伤性免疫细胞,如CD8+ T细胞和NK细胞的浸润增多,CD8+ T细胞的活性增强,而抑制性免疫细胞MDSC细胞和Treg细胞的浸润减少(见图5)。
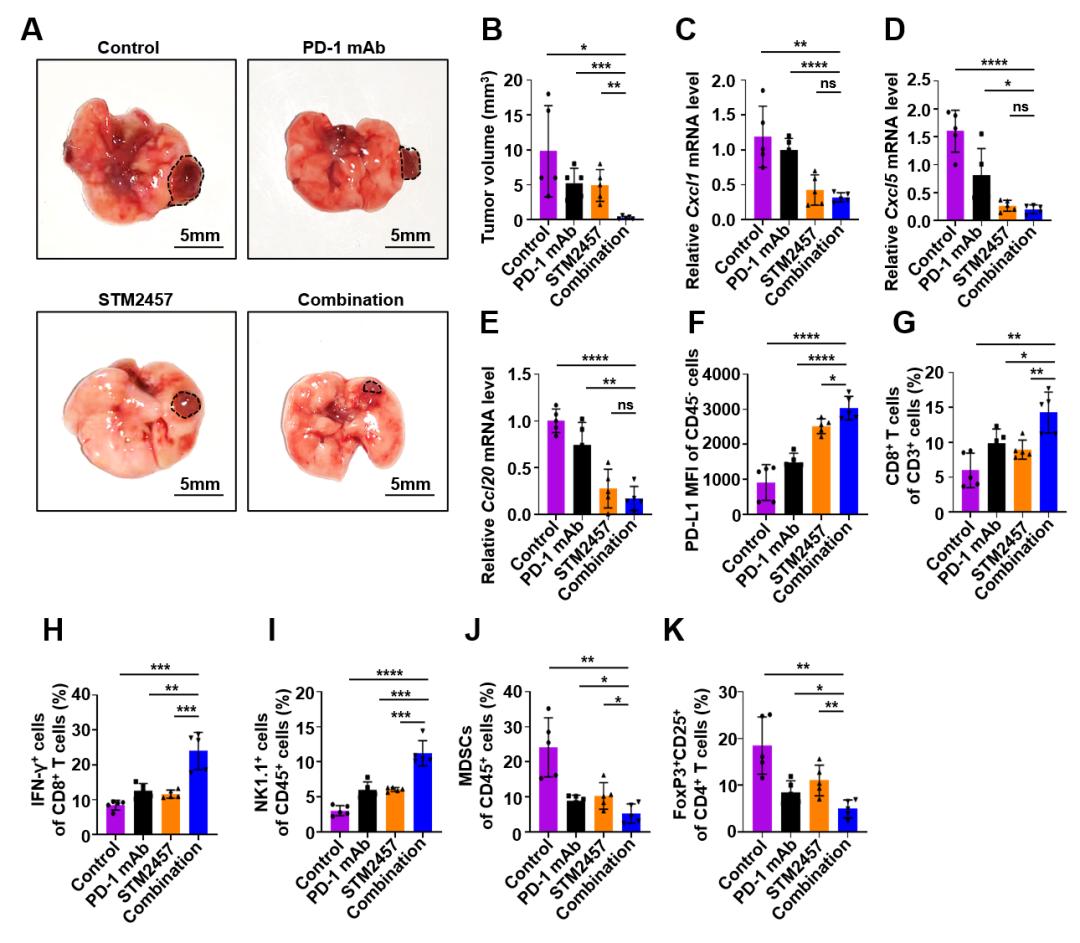
图5 METTL3抑制剂与PD-1抗体联用可以显著抑制肺癌的生长。(A)原位接种LLC到小鼠肺叶,经过治疗后,肺组织的代表性图片;(B)对肺叶中肿瘤组织称重统计;(C-E)检测到联用组的肿瘤组织中Cxcl1、Cxcl5和Ccl20的mRNA水平发生显著下调;(F)联用处理后,肿瘤组织中癌细胞表达PD-L1水平显著上升;(G-K)联用处理后,肿瘤微环境中杀伤性免疫细胞,CD8+ T细胞(G),IFN-γ+ CD8+ T细胞(H)和NK细胞(I)比例显著上调,而抑制性免疫细胞MDSC细胞(J)和Treg细胞(K)比例显著下调。
综上所述,研究者发现通过靶向METTL3,可以将冷肿瘤转变为热肿瘤,从而增强NSCLC对抗PD-1免疫治疗的敏感性。此外,临床观察表明,低表达METTL3的NSCLC患者在接受抗PD-1治疗后,其预后更为良好。
作者专访
Cell Press细胞出版社公众号特别邀请张金方教授代表研究团队接受了专访,请他为大家进一步详细解读。
CellPress:
首先请您简要介绍为什么选择METTL3作为研究对象?
张金方教授:
首先,METTL3介导的RNA m6A修饰在真核生物中是最为广泛的一种转录后修饰,在调控基因表达方面扮演着重要的角色,参与了生理和病理过程中的多种关键调控。此外,已有大量研究表明METTL3在多种癌症类型中具有调控作用。然而,前期研究发现METTL3在不同类型的癌症中可能扮演截然相反的角色,这表明其在肿瘤发生发展过程中的功能尚需进一步探讨。至于在肺癌中,METTL3如何调控肿瘤微环境以及免疫治疗的应答目前尚不清楚。近期发现的METTL3特异性抑制剂STM2457为临床上针对METTL3进行靶向治疗提供了新的可能性,特别是与PD-1抗体免疫治疗联合使用,为肿瘤治疗提供了一种潜在的治疗策略。
CellPress:
您认为此研究的亮点是什么?
张金方教授:
尽管之前的研究已对METTL3在调控其他类型肿瘤发生发展中的机制做出了解释,但关于METTL3如何影响肺癌的肿瘤微环境变化以及免疫治疗效果并没有得到详细的探讨。因此,我们的研究发现,在非小细胞肺癌中,METTL3通过调控c-Myc来调节促癌型趋化因子CXCL1、CXCL5和CCL20的表达,从而招募抑制性免疫细胞MDSC细胞和Treg细胞。此外,METTL3介导PD-L1 mRNA的m6A修饰,促进其降解,导致形成非炎症性的肿瘤微环境(冷肿瘤),从而降低了肺癌患者对免疫治疗的响应率。另外,我们还发现METTL3抑制剂STM2457与PD-1抗体联合治疗,可以显著提升临床前肺癌小鼠模型的治疗效果,为STM2457联合PD-1抗体作为潜在的治疗方案应用于肺癌治疗提供了理论基础。
CellPress:
您的团队下一步有什么研究计划?
张金方教授:
在临床治疗过程中,癌症的复杂性使得治疗面临着重重困难。通过本研究,我们看到表观遗传修饰在肿瘤发生发展过程中的重要作用以及其在临床应用中的潜力。因此,在接下来的研究中,我们将进一步探究其他类型的表观遗传修饰对肿瘤发生发展的影响。同时,鉴于免疫检查点在肿瘤发生发展中的重要调控作用和应用价值,我们也将继续研究其他免疫检查点的调控机制。这些努力有望为深化对癌症治疗机制的理解以及开发新的治疗策略提供重要的理论和实践基础。

作者介绍

张金方
教授
张金方,武汉大学医学研究院/教育部免疫与代谢前沿科学中心/武汉大学中南医院/泰康生命医学中心教授。以通讯作者/第一作者发表研究成果于Nature,Cancer Discovery,Molecular Cell,PNAS,Nature communications,Cell Chemical Biology等国际知名期刊。
相关论文信息
论文原文刊载于Cell Press细胞出版社旗下期刊Cell Chemical Biology上,
▌论文标题:
Targeting METTL3 reprograms the tumor microenvironment to improve cancer immunotherapy
▌论文网址:
https://www.cell.com/cell-chemical-biology/abstract/S2451-9456(23)00291-X
▌DOI:
https://doi.org/10.1016/j.chembiol.2023.09.001
的前身Cell Press Community Review模式于2021年推出。对于通过Cell Press Multi-Journal Submission“多刊审稿”模式投稿的作者,我们将提供稿件被至多6本期刊同时考虑的机会。超过80%通过Cell Press Multi-Journal Submission“多刊审稿”模式投稿的文章获得了至少一个或多个期刊的评审。

