乏氧在实体瘤中很常见,可刺激欺骗性肿瘤外泌体的传播,这些外泌体作为通讯桥梁,协调招募各种支持细胞类型,以增强肿瘤在肿瘤免疫微环境中的适应性。
目前的纳米技术为我们提供了对抗肿瘤乏氧微环境的智能策略。然而,一旦暴露于外部刺激(例如化疗),肿瘤细胞会同时释放恶性信号,发生肿瘤迁移和免疫抑制,给临床实践带来挑战。
近日,国家纳米科学中心陈春英院士课题组在 ACS Nano 期刊发表了题为:Hydrogel-Mediated Jamming of Exosome Communications That Counter Tumor Adaption in the Tumor Immune Microenvironmen 的研究论文。
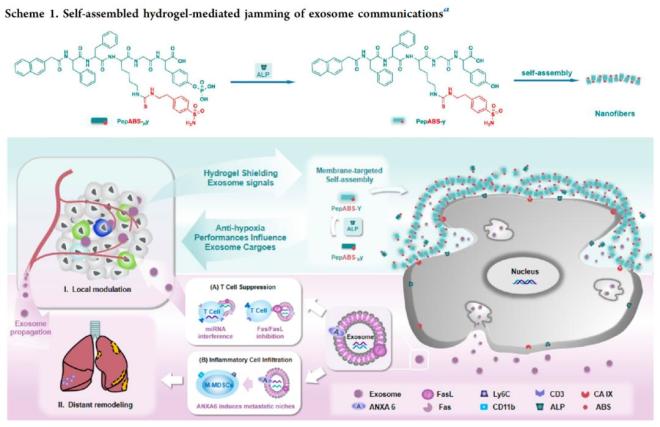
该研究利用靶向肿瘤细胞膜的短肽纳米纤维材料,通过干扰肿瘤外泌体通讯,抑制肿瘤免疫微环境中的肿瘤适应性。该研究首次报道了通过在乏氧肿瘤细胞表面形成纳米纤维状水凝胶结构,抑制肿瘤外泌体扩散,同时携带碳酸酐酶IX(CA IX)抑制剂以缓解肿瘤低氧环境,最终增强免疫系统对肿瘤的杀伤能力,实现治疗过程中更高效的肿瘤微环境时空控制治疗策略。

陈春英院士团队与合作团队在高效低毒抗肿瘤纳米药物的研制及作用机制研究方面已获得一系列进展。该团队前期研究已获得一种特异性杀伤乏氧肿瘤细胞的自组装短肽纳米纤维材料。该材料通过靶向乏氧肿瘤细胞膜上的CA IX酶并发生自组装,特异性杀伤乏氧肿瘤细胞。在该研究基础上,团队进一步通过在乏氧肿瘤细胞表面形成纳米纤维状水凝胶结构,抑制肿瘤外泌体扩散,同时携带CA IX抑制剂以缓解肿瘤低氧环境,最终提高免疫系统对肿瘤的浸润与杀伤能力,以此全面改善肿瘤及其转移微环境,提升抗肿瘤作用效果。
当前纳米技术为我们提供多种智能策略来对抗乏氧的肿瘤微环境,然而,通过切断肿瘤内部及远距离通讯,实现肿瘤微环境全面改善的治疗方式仍有待系统探索与研究。基于此,陈春英院士团队设计了一种靶向肿瘤细胞膜的磷酸酶响应型短肽自组装分子(PepABS-py)。该研究显示,它能在肿瘤细胞膜表面形成水凝胶,有效捕捉并抑制肿瘤细胞释放的外泌体,阻止其在肿瘤微环境中的传播,以及对肿瘤免疫微环境的产生调节作用。
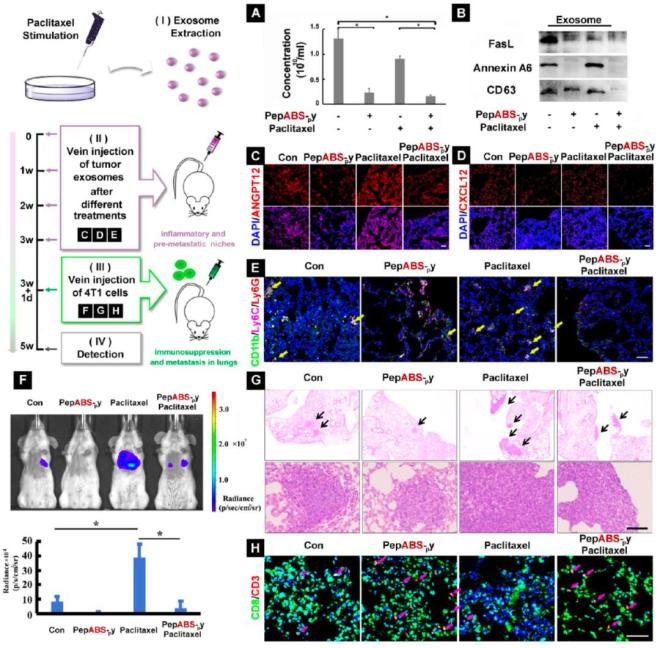
在乏氧肿瘤微环境中,水凝胶对肿瘤外泌体中的miRNA表达产生了显著调控,特别是在T细胞信号传导过程中,增强了CD8+ T细胞的增殖与浸润,改善了肿瘤内部的免疫抑制微环境,从而进一步减弱肿瘤在乏氧微环境下的适应能力。
值得关注的是,在与化疗药物联用时,该水凝胶材料还能显著限制肿瘤细胞与其它器官之间的远距离交流,有效重塑远端肺组织中的免疫与炎性微环境,抑制化疗刺激诱导的肿瘤细胞转移风险。
综上所述,该研究展示了通过水凝胶阻断肿瘤外泌体通讯从而抑制肿瘤适应性的新策略。不仅提高了抗肿瘤免疫反应,还在体内实验中展现出降低肿瘤转移和增强化疗效果的潜力,具有重要的临床应用前景。
自组装水凝胶介导的外泌体通讯干扰
国家纳米科学中心博士后史可鉴、博士生付文娇、博士生Zeinab Farhadi Sabet为该文共同第一作者,陈春英院士为论文最后通讯作者,李佳阳博士为论文共同通讯作者,该研究得到国家重点研发计划、国家自然科学基金和中国科学院战略性先导科技专项等项目支持。
论文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c07603

