TCR-T疗法,一种创新的免疫细胞治疗,通过基因改造T细胞精确攻击癌细胞。该疗法已向FDA提交上市申请,针对晚期滑膜肉瘤,显示卓越疗效,预示抗癌治疗的新篇章。
全球首款TCR-T细胞疗法将上市
用于治疗晚期滑膜肉瘤
在2024年1月31日,英国的生物医药公司Adaptimmune公开宣布,他们研发的TCR-T疗法——Afami-cel,已经向美国食品和药物管理局(FDA)提交了上市申请,并且得到了优先审评的资格。FDA为这款新药的申请设定了目标批准日期,即PDUFA日期,为今年的8月4日。这款疗法是专门针对晚期滑膜肉瘤的治疗。

Afami-cel有望成为全球首款针对实体瘤的T细胞疗法,也是首款TCR-T疗法。如果它能够成功上市,那将是一个重要的里程碑。
滑膜肉瘤是软组织肿瘤的一种。在美国,每年有大约13000人新诊断为软组织肿瘤,其中5-10%的患者患有滑膜肉瘤。这种病症的五年生存率仅为20%,显然,临床上对于这种病症的治疗需求远远没有得到满足。如果Afami-cel获得批准,它将成为首款在美国商业上获得批准的,用于治疗实体肿瘤的TCR-T细胞疗法。
什么是TCR-T疗法?
它的效果又如何?
当我们谈到免疫细胞治疗时,大家可能首先会想到的是CAR-T、NK、CIK等细胞疗法。那么,TCR-T疗法到底是什么?它的效果又如何呢?
TCR-T技术,也被称为T细胞受体嵌合型T细胞技术,或者亲和力增强的TCR技术。简单来说,这种技术就是从患者身上提取T细胞,并为这些T细胞配备新的T细胞受体,使它们能够精确地靶向特定的癌症抗原。这种创新的疗法允许医生根据每个患者的肿瘤特性和不同类型的T细胞,选择最合适的靶点进行工程改造,从而实现个体化治疗,为患者带来更大的治愈希望。
与CAR-T疗法相比,TCR-T疗法在治疗实体瘤方面具有独特的优势。由于MHC分子能够展示来自细胞表面和细胞内蛋白的肽链,TCRs与CARs相比,能够识别并攻击更多种类的抗原。当TCR-T和CAR-T同时攻击实体瘤时,TCR-T能更广泛地与肿瘤细胞结合,使药物分布更为均匀。相反,CAR-T通常只会附着在肿瘤的外层,难以渗透到内部,因此其有效率相对较低。
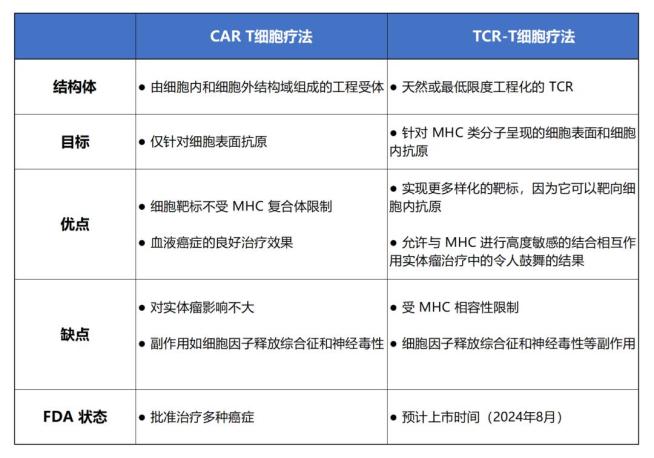
CAR-T和TCR-T疗法比较
根据美国临床试验注册中心的数据,目前正在研究的TCR-T治疗实体瘤的种类相当多样,主要涵盖了转移性非小细胞肺癌、肝细胞癌、多发性骨髓瘤、软组织肉瘤、头颈癌、黑色素瘤、脂肪肉瘤以及宫颈癌等。这些研究主要集中在美国和中国。在国内,TCR-T细胞治疗也取得了显著的进展,其中多个研究项目已经进入临床阶段,进展最快的靶点包括NY-ESO-1、HPV E6/7、AFP和HBV等。
TCR-T治疗胰腺癌治疗:
注射巨量免疫细胞后肿瘤大幅缩小
2022年6月,《新英格兰医学杂志》刊登了一篇引人注目的研究报告,揭示了一种新型免疫疗法——TCR-T疗法的显著疗效。该研究报告的标题为“胰腺癌中的新抗原T细胞受体基因治疗”。

研究中,一位患有转移性胰腺癌晚期(KRAS G12D突变)的病患,在接受了一次性注射高达162亿个免疫细胞后,仅一个月,其体内的肿瘤转移灶就开始出现消退。令人震惊的是,六个月后的评估显示,患者的病灶竟然缩小了72%!这一疗法似乎有效地遏制了晚期胰腺癌的恶化。
这位受益者是一位72岁的女性患者(编号CRI-4483),她成为了全球首位因这种疗法而受益的晚期胰腺癌患者。
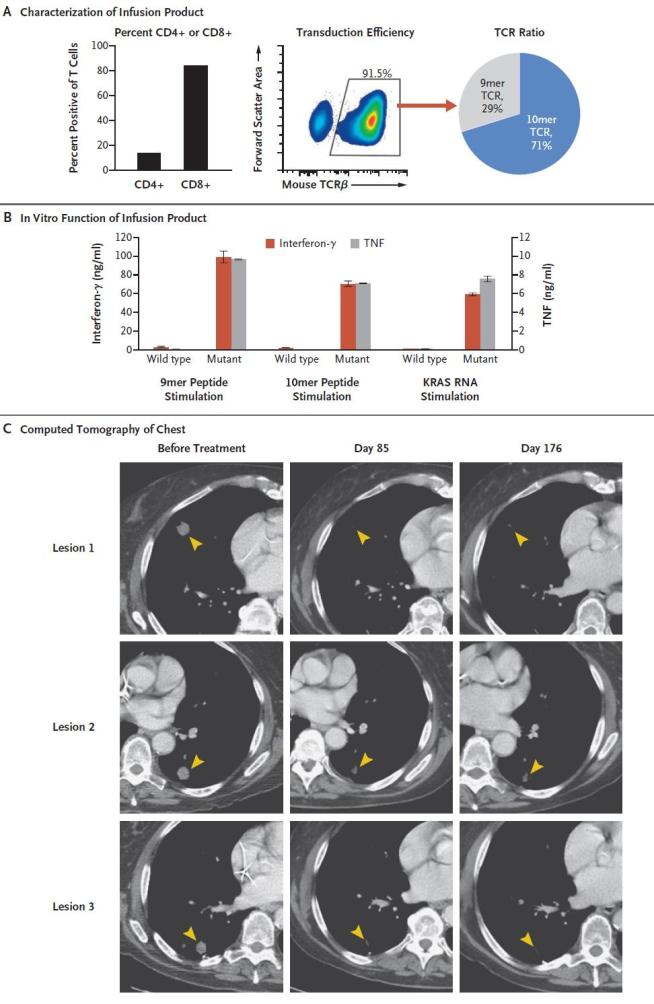
针对肠癌患者的 KRAS G12D 工程T细细胞制备,以及输注前以及输注后 85 天和176天时患者胸部的对比增强计算机断层扫描扫描结果
该患者在2018年被诊断为胰腺癌,当时她67岁。随后,她接受了四个周期的FOLFIRINOX新辅助治疗,这是一种包含氟尿嘧啶、亚叶酸、伊立替康和奥沙利铂的联合化疗方案。之后,她进行了保留幽门的开放性Whipple切除术,成功切除了一个边缘阴性、伴有两个淋巴受累的低分化腺癌,肿瘤最大尺寸为4.5厘米。
经过治疗,她的疾病分期为IIB。接下来,她又接受了四个周期的FOLFIRINOX辅助治疗,并进行了剂量为50.4Gy的辅助放化疗,同时配合卡培他滨治疗。
虽然治疗结束后,她一度得到缓解,肿瘤未再出现转移。然而到了2019年,癌症再次复发。医生通过肺右下叶的细针穿刺,证实了肺转移的存在。
2020年,这位患者参与了匹兹堡大学医学中心的肿瘤浸润淋巴细胞治疗临床试验,尝试了一种全新的免疫细胞疗法-TILs治疗。但遗憾的是,在六个月内观察到肺转移瘤持续增长,该治疗未能取得成功。
在面临绝境之际,这位患者得知了FDA在2021年5月批准的一项针对单一患者的新型免疫疗法临床实验——TCR-T研究性新药申请。抱着最后一线希望,她决定参加这项实验。
在2021年的6月,这位患者正式参与了临床试验。试验过程中,科研人员首先从患者体内提取了T细胞,并在实验室环境下对这些细胞进行了基因改造。通过这样的方式,他们成功地制造出了大量的TCR-T细胞,这些细胞能够特别地识别并攻击患者身体内带有KRAS G12D突变的癌细胞。之后,这些经过特殊改造、能够精确对抗癌细胞的T细胞被重新注入到患者体内。
在细胞注入前的五天,患者开始接受托珠单抗(600mg,通过静脉给药)和环磷酰胺(按照体重,每天每千克30mg,也是通过静脉给药,并持续两天)的预处理。
患者接受了一次性的16.2×109个自体T细胞输注。输注完成后18小时,患者又开始接受大剂量的白细胞介素治疗(600,000 IU/kg,每8小时通过静脉注射一次,共计五次)。
令人惊喜的是,接受治疗仅仅一个月后,患者体内的肿瘤转移灶就开始减小;到了六个月后,经过专业评估,患者的病灶竟然缩小了高达72%。
如今,TCR-T疗法因其独特的优势,如能够识别细胞内外特异的肿瘤抗原、对实体瘤的靶向效果更佳、在体内存留时间更长等,已经引起了科研人员的广泛关注,并被誉为新一代的抗肿瘤“利器”。在多种实体瘤的治疗中,该疗法已经显现出了卓越的效果,特别是在肝癌、黑素瘤和滑膜细胞肉瘤的治疗上效果尤为显著。多项临床研究也证实了TCR-T在治疗癌症和病毒感染中的可行性、安全性和有效性。
我们坚信,随着科研的深入和技术的进步,TCR-T疗法将会在临床治疗中取得更加显著的成果,为更多的患者带来希望,成为我们抗击癌症的有力武器。让我们共同期待这一具有革命性的治疗方法能够早日普及,造福更多的患者。

